近期,上海科技大學iHuman研究所徐菲課題組在新興藥物靶點G蛋白偶聯受體(G protein-coupled receptor, GPCR)研究領域再傳捷報,成功解析了多發性骨髓瘤重磅靶點GPRC5D、腸道炎癥新靶點GPR15以及神經精神疾病新靶點TAAR1復合物的高分辨率三維結構,闡明了三類靶點辨識配體或藥物分子的分子機制。相關研究成果先後線上發表於國際學術期刊【自然-通訊】( Nature Communications )、【細胞發現】( Cell Discovery )和【細胞報告】( Cell Reports ),為相關疾病的新藥研發提供了深刻見解。



解碼GPRC5D:多發性骨髓瘤抗體藥物作用機制的新見解
GPRC5D屬於特殊的C家族孤兒受體,其N端僅有20多個胺基酸。作為多發性骨髓瘤的新興治療靶點,GPRC5D近年來廣受關註。2023年,FDA批準了首款靶向GPRC5D以及CD3的雙抗talquetamab,用於多發性骨髓瘤的治療。此外,還有數十款靶向GPRC5D的雙抗、CAR-T以及其他產品處於臨床試驗研究階段,顯示了該靶點的巨大潛力。
徐菲團隊利用冷凍電鏡技術解析了GPRC5D與臨床前管線中治療性抗體的復合物結構,並行現了GPRC5D獨特的二聚化結構特征。透過詳細的結構分析,研究團隊發現GPRC5D與抗體的結合具有廣泛的相互作用界面,並證實了關鍵結合位點的作用,為後續高親和力抗體的設計提供了基礎。研究還證實,GPRC5D形成的同源二聚體界面位於受體的第四個跨膜螺旋上,並首次提出了GPRC5亞家族內保守的二聚體界面結構基序。該研究有助於基於結構設計新一代抗體藥物或最佳化目前已有的抗體藥物,為治療多發性骨髓瘤提供新策略,該項成果以「The binding mechanism of an anti-multiple myeloma antibody to the human GPRC5D homodimer」為題,於6月19日線上發表於【自然-通訊】( Nature Communications )。
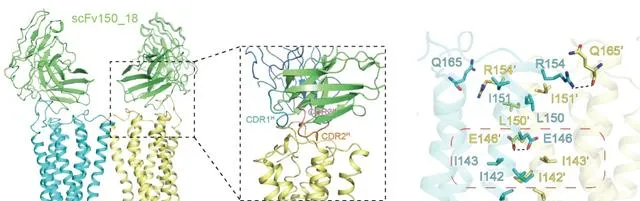
圖1. GPRC5D與抗體復合物的結構及二聚體界面
腸道免疫新發現:GPR15與GPR15L的獨特結合
GPR15屬於 class A類GPCR的孤兒受體,分布於多種組織,在調節腸道免疫穩態和炎癥反應方面發揮重要作用。徐菲團隊利用冷凍電鏡技術解析了GPR15與其內源性配體GPR15L的結構,發現GPR15L以「V」字型方式與GPR15結合,這與傳統的趨化因子辨識機制顯著不同。研究發現,GPR15上的K261 6.55 ,Y40 1.39 和F257 6.51 ,F292 7.43 等殘基對GPR15L的辨識至關重要。研究揭示了非典型趨化因子GPR15L與傳統趨化因子在辨識機制上的差異,也揭示了GPR15與其內源性配體相互作用的辨識和啟用機制。這一發現對多肽類或抗體類藥物的設計具有重要的指導意義。該項成果以「Molecular recognition of the atypical chemokine-like peptide GPR15L by its cognate receptor GPR15」為題,於6月25日線上發表於【細胞發現】( Cell Discovery )。
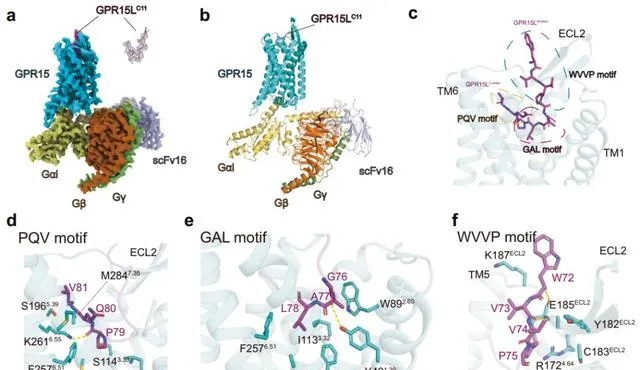
圖2. GPR15L與GPR15的結合模式及相互作用界面
TAAR1研究新突破:為神經精神疾病治療提供新視角
痕量胺相關受體1(Trace Amine-Associated Receptor 1, TAAR1)是 class A類GPCR受體,廣泛分布於中樞和外周神經系統,對調節多巴胺、血清素和谷胺酸等神經遞質至關重要。其功能異常與精神分裂癥、抑郁、焦慮和帕金森病等多種神經精神疾病相關。作為精神疾病治療的潛在靶點,TAAR1激動劑有望在減少副作用和成癮治療方面展現優勢。2023年11月,徐菲團隊與合作者在國際上率先報道了TAAR1與多種胺類配體結合的結構,揭示了TAAR1辨識精神活性物質和藥物候選分子的精細結構與啟用機制,為新藥開發提供了重要線索。基於此,徐菲團隊聯合iHuman研究所趙素文團隊利用結構生物學和分子動力學模擬等方法,進一步解析了TAAR1與致幻劑LSD、部份激動劑RO5263397以及無配體狀態下的高分辨率結構。研究成果於7月11日以「The Versatile Binding Landscape of TAAR1 Pocket for LSD and Other Antipsychotic Drug Molecules」為題在【細胞報告】( Cell Reports )線上發表。
研究顯示,TAAR1結合LSD時展示了一個區別於5-羥色胺受體的「深度結合」模式。關鍵殘基F186和D103周圍氫鍵網絡構成了TAAR1的獨特辨識和啟用機制的結構基礎。TAAR1的這些特性不僅為藥物設計提供了分子細節,也為理解其多功能性及開發新的TAAR1調節劑提供了新見解。隨著對TAAR1結合特性的深入研究,這些發現有望推動神經精神疾病的藥物治療取得突破性進展。
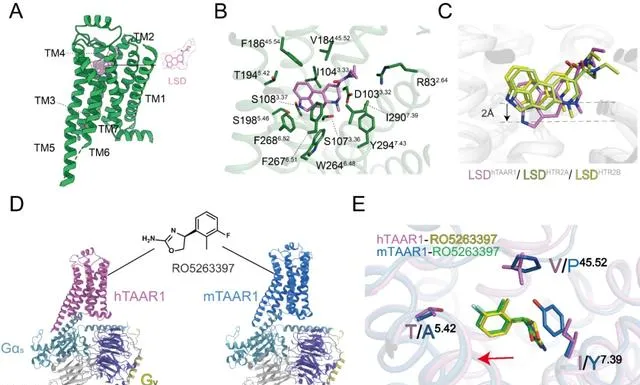
圖3. TAAR1與不同配體的結合模式及相互作用界面
論文連結:
1. https://www.nature.com/articles/s41467-024-49625-y
2. https://www.nature.com/articles/s41421-024-00698-5
3. https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00834-9











