7月25日,中國科學院上海藥物研究所天然藥物研發中心郭躍偉/李序文團隊聯合代謝疾病研究中心李佳團隊在 Journal of Medicinal Chemistry 上發表了題為【The First Discovery of Marine Polyoxygenated Cembranolides as Potential Agents for the Treatment of Ulcerative Colitis】的研究成果,並被選為 補充封面文章 。合作團隊對海洋軟珊瑚中典型西松烷二萜類分子進行了定向挖掘和系統構效關系分析,並對抗炎機制和體內抗潰瘍性結腸炎(Ulcerative Colitis, UC)藥效評價做了深入研究, 充分展示了海洋天然產物—西松烷內酯可作為治療潰瘍性結腸炎藥物的候選分子。


潰瘍性結腸炎(UC)是一種腸道慢性非特異性炎癥性疾病,臨床表現為血便、腹瀉和腹痛。UC在全球發病率日益上升,尤其是在亞洲和非洲等許多新興工業化地區。盡管UC的病因仍不明確,但人們普遍認為該疾病的發生是外源物質引起宿主反應、基因和免疫三者交互作用的結果,病理機制涉及粘膜免疫系統穩態紊亂和腸上皮屏障受損。目前,可采用手術的方法或使用皮質類固醇、胺基水楊酸和抗生素等傳統藥物治療UC,但這些藥物存在嚴重的不良反應,且成本較高,只能在短期內緩解病情,無法實作疾病治愈和長期的預防。因此,迫切需要以全新的視角開發新型的UC治療藥物。
在該項研究中,研究人員首先利用基於HSQC的SMART導向技術,從中國南海軟珊瑚 Sinularia pedunculata 中快速、精準定位具有特征結構的餾分,並從中分離出31個西松烷二萜,含6個新化合物,其中包括21個西松烷內酯。值得關註的是,sinupedunolide A (1) 具有罕見的在C-4和C-9位形成的過氧橋。有趣的是,sinupedunol A (2) 具有少見的七元醚環,而不具備 α, β -不飽和內酯的結構片段。除了新穎化合物的發現,大樣本量且結構多樣的西松烷二萜的獲得也為後續系統構效關系分析提供了堅實基礎。
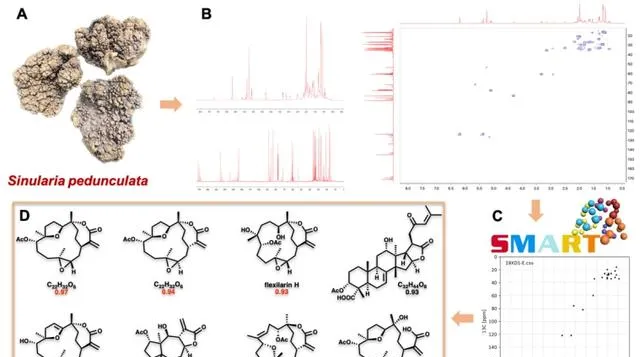
圖1. 基於HSQC的SMART快速導向分離
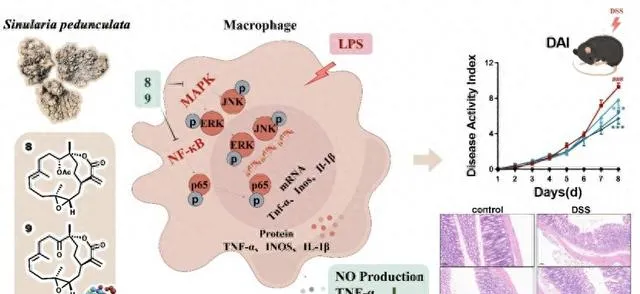
巨噬細胞極化在炎癥的進展中起著重要作用,通常由LPS誘導,特征是誘導型一氧化氮合酶(iNOS)的高表達、NO的產生和促炎細胞因子的分泌。由於西松烷二萜有過抗炎活性的報道,為了進一步系統研究它們的潛在抗炎功效,研究人員測試了分離所得的31個西松烷二萜對LPS誘導的RAW264.7細胞中NO產生的抑制作用,結果表明具有 α, β -不飽和內酯的西松烷二萜普遍具有顯著的生物活性,其IC 50 值在亞微莫耳級別。構效分析表明,內酯片段是重要的活性來源,3,4位元環氧的存在對活性有益。此外,C-11位的 β 取代顯示出更好的活性,而在C-4至C-8的氧化對活性幫助不大,甚至可能導致活性的喪失。值得註意的是,化合物8和9表現出最優的抗炎活性,可顯著抑制多種促炎細胞因子的轉錄和分泌。
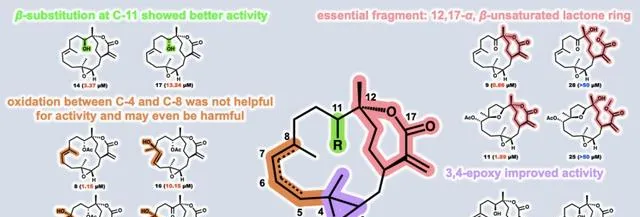
圖2. 西松烷二萜的構效關系分析
進一步機制研究發現化合物8和9顯著抑制了NF-κB的轉錄活性,降低p65、ERK和JNK的磷酸化,抑制NF-κB和MAPK訊號通路,從而減少炎癥因子的產生。更為重要的是,在葡聚糖硫酸鈉(DSS)誘導的小鼠急性潰瘍性腸炎模型中,化合物8和9可以有效緩解結腸炎癥,顯著降低疾病活動指數(DAI)評分,及H&E組織病理學評分,同時抑制結腸中炎癥細胞因子的表達,並改善腸道屏障的完整性。
總之,這項完全基於天然產物的化學多樣性所開展的純天然藥物化學研究首次深入探索了海洋分子—西松烷內酯對UC的作用機制及其體內藥效,為進一步開發西松烷內酯成為創新型UC藥物提供了分子樣版和骨架參考。
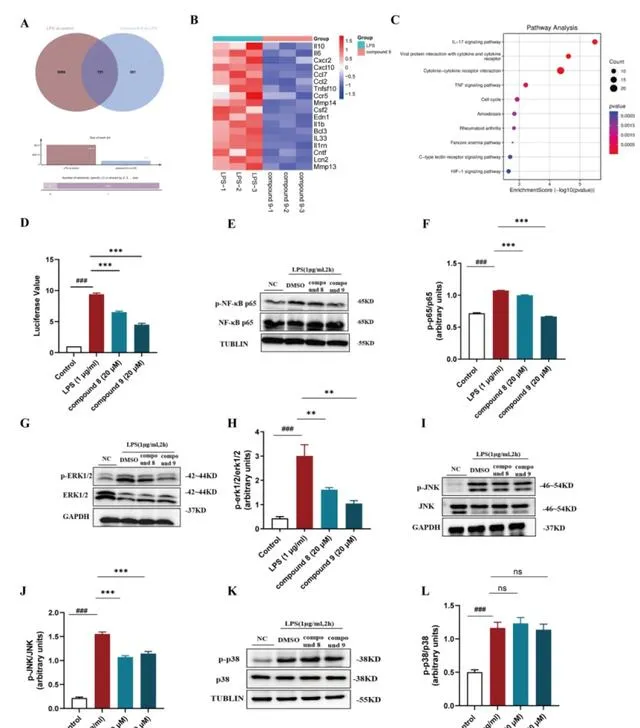
圖3. 化合物8和9抑制NF-κB和MAPK訊號通路
中國藥科大學和上海藥物所聯合培養碩士研究生崔媛媛、南京中醫藥大學和上海藥物所聯合培養碩士研究生金洋(現中山大學和上海藥物所聯合培養博士研究生)和上海藥物所碩士研究生孫若楠為本文共同第一作者,上海藥物所李序文研究員、李佳研究員、郭躍偉研究員和孫一立副研究員為本文共同通訊作者。 該工作得到上海市科學技術委員會等相關單位的資助。 特別感謝陳凱先院士的大力指導和幫助。
全文連結
https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c00950











